QSD 申請代辦輔導
國外製造醫療器材 QSD 申請輔導與模式選擇指南
國外製造的醫療器材在輸入台灣前,須依衛生福利部食品藥物管理署(TFDA,Taiwan Food and Drug Administration)規範,提交符合國際品質管理要求的 QSD(Quality System Documentation)文件。QSD 旨在確認製造廠之品質管理系統已與 ISO 13485 接軌,確保產品設計與製造過程具備品質一致性。
1.申請書正本(2份)
用途:
• 用於正式提出 QSD 申請
• 包含製造廠資料、輸入業者資料及申請品項
提供者:
• 由輸入業者填寫並簽章。
2.醫療器材販賣業許可執照影本
用途:
• 證明輸入業者具備合法申請資格
重點:
• 必須為有效期限內
• 影本需清晰
3.原廠說明文件正本
用途:
• 證明原廠授權輸入業者進行 QSD 申請
• 證明產品確由該製造廠生產
重點:需提供原廠蓋章正本。
4.ISO 13485證書
用途:
• 證明製造廠符合醫療器材品質管理要求
重點:
• 必須為有效期限內
• 必須由 TFDA 認可的查驗機構核發
5.各項產品製造流程
內容:
• 製程流程圖
• 生產步驟
• 製程管制點
• 無菌製程(如適用)
用途:確認工廠具備量產能力。
6.醫療器材檔案清單
內容:
• 設計資料
• 測試報告
• 風險管理文件
• 檢驗與驗證方法
• 包裝/滅菌資訊(如適用)
用途:供 TFDA 審查技術文件完整性。
7.查廠報告
要求:
• 必須提供最近 3 年內查廠報告
• 由認可查驗機構出具
內容:
• ISO 13485 稽核結果
• 不符合項目與改善報告
• 製程驗證內容
8.️全廠配置圖
需標示:
• 生產區
• 無塵室
• 倉儲
• 包裝區
• 品管區
• 物流與人員動線
9.各類產品製造作業
需標示:
• 各製程的位置
• 專用空間
• 設備配置
用途:讓 TFDA 確認生產動線。
10.主要製造及檢驗設備
需列示:
• 生產設備
• 檢驗儀器
• 滅菌/無菌設備(如適用)
• 校正記錄(如適用)
11.品質手冊
內容:
• 品質政策
• 組織架構與職責
• 品質系統架構說明
用途:審查工廠品質管理制度是否完整。
12.文件總覽表
內容:
• 全部 QMS 文件
• 程序書
• 標準作業程序
• 表單/紀錄文件名稱與版本
13.品質系統程序文件
內容:
• 品質管理系統運作所需的各項程序書
• 含設計、採購、生產、品管、供應商管理等程序
用途:提供 TFDA 審查 QMS 是否實際運作。
14.原製造許可
適用於:
• 追加品項申請
• 展延案
用途:核對原核准資訊的一致性。
1.申請書正本(2份)
用途:
• 用於正式提出 QSD 申請
• 包含製造廠資料、輸入業者資料及申請品項
提供者:
• 由輸入業者填寫並簽章。
2.醫療器材販賣業許可執照影本
用途:
• 證明輸入業者具備合法申請資格
重點:
• 必須為有效期限內
• 影本需清晰
3.原廠說明文件正本
用途:
• 日本製造廠授權輸入業者進行申請
• 證明產品確為該廠製造
重點:需提供蓋章正本。
4.ISO 13485 證書
用途:
• 證明品質系統符合醫材製造要求
限制:
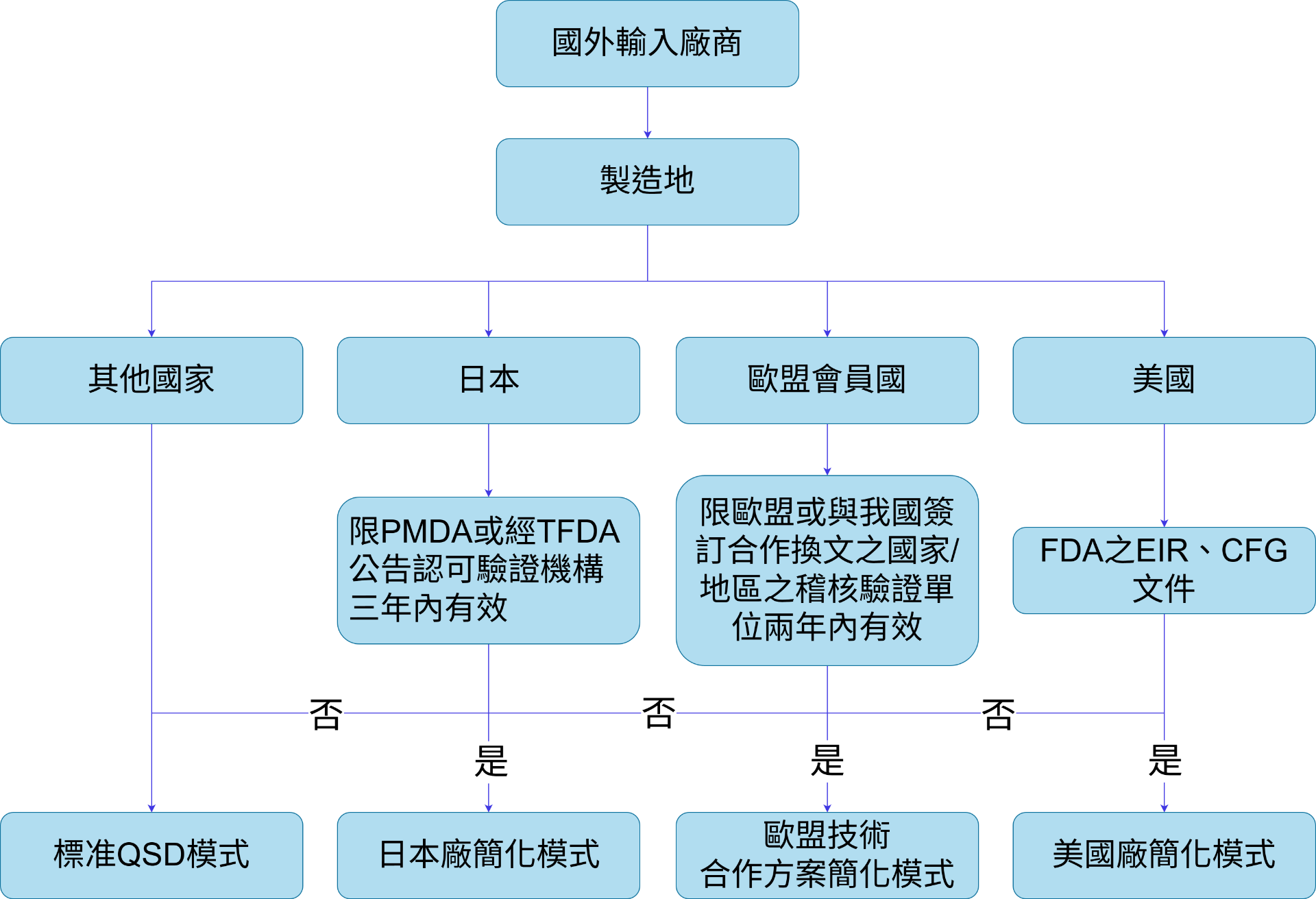
• 必須由 TFDA 公告之日本查驗機構核發
• 必須為有效期限內
查驗機構例:
• PMDA
• BSI Japan
• TÜV Rheinland Japan
• SGS Japan
• TÜV SÜD Japan
5.各項產品製造流程
內容:
• 製程流程圖
• 每步驟作業說明
• 管制點標示
• 無菌流程(如適用)
用途:確認具備量產能力。
6.醫療器材檔案清單
內容:
• 設計資料
• 測試報告
• 風險管理文件
• 檢驗方法
• 包裝與滅菌資訊
用途:供 TFDA 核對技術文件完整性。
7.查廠報告
要求:
• 由日本查驗機構出具
• 必須為最近 3 年內的報告
內容:
• ISO 13485 稽核內容
• 缺失與改善紀錄
• 製程驗證資料
8.全廠配置圖
需標示:
• 生產區與倉儲區
• 品管區
• 包裝區
• 無塵室
• 物流/人員動線
9.各類產品製造作業區域
需標示:
• 各製程所在位置
• 專用空間
• 設備配置
通常與全廠配置圖一起審查。
10.主要製造及檢驗設備
需列示:
• 生產設備
• 檢驗儀器
• 無菌/滅菌設備
• 校正狀況(如適用)
11.品質手冊
內容:
• 品質政策
• 組織分工與職責
• 系統流程說明
用途:確認工廠品質系統運作符合 ISO。
12.文件總覽表
內容:
• 全部 QMS 文件清單
• 程序書
• SOP
• 表單與紀錄文件編號與版本
13.原製造許可
適用於:
• 追加品項
• 展延案
用途:供 TFDA 比對原核准資訊。
️1.申請書正本(2份)
用途:
• 用於正式提出 QSD 申請
• 包含製造廠資料、輸入業者資料及申請品項
提供者:
• 由輸入業者填寫並簽章。
2.醫療器材販賣業許可執照影本
用途:
• 證明輸入業者具備合法申請資格
重點:
• 必須為有效期限內
• 影本需清晰
3.原廠說明文件正本
用途:
• 證明該產品確由原製造廠生產
• 授權輸入業者向 TFDA 提出 QSD 申請
重點:
• 必須提交原廠蓋章正本
4.ISO 13485證書
限制:
• 證書必須由「與台灣簽署技術合作換文之 EU 查驗機構」核發
• 不符合公告名單者 → 退件
重點:
• 必須為有效期限內
參考來源:請見 TFDA 最新公告之「臺歐醫療器材技術合作方案」
5.各項產品製造流程
內容:
• 製程流程圖
• 每製程的作業步驟與控制點
• 無菌流程(如適用)
用途:審查工廠是否具備該醫材的量產能力。
6.醫療器材檔案清單
內容:
• 設計檔案
• 測試資料
• 風險管理文件
• 檢驗方法
• 包裝與滅菌資料(如適用)
用途:TFDA 用以比對技術文件完整性。
7.查廠報告
要求:
• 必須由臺歐合作換文所認可的查核機構出具
• 出具日期須在最近 3 年內
內容:
• ISO 稽核內容
• 不符合項目與改善紀錄
• 製程驗證項目
8.製售證明
內容:
• 由所在地最高衛生主管機關(如 EU 成員國主管機關)出具
• 證明該產品可合法製造與銷售
效期要求:
• 限「出具日起二年內」有效
用途:
• 提供 TFDA 核對產品法規狀態
9.原製造許可
適用於:
• QSD 追加品項
• 展延案
用途:
• 提供 TFDA 核對原有核准內容與變更一致性。
1.申請書正本(2份)
用途:
• 用於正式提出 QSD 申請
• 包含製造廠資料、輸入業者資料及申請品項
提供者:
• 由輸入業者填寫並簽章。
2.醫療器材販賣業許可執照影本
用途:
• 證明輸入業者具備合法申請資格
重點:
• 必須為有效期限內
• 影本需清晰
3.原廠說明文件正本
用途:
• 證明該醫療器材由美國製造廠生產
• 原廠授權輸入業者向 TFDA 提出 QSD 申請
提供者:
• 由美國製造廠出具、蓋章並提供正本
4.ISO 13485證書
用途:
• 證明製造廠具備符合醫療器材品質要求之品質管理系統
提供者:
• 由美國製造廠提供有效之 ISO 13485 證書
(依 TFDA 最新公告規定檢附)
5.各項產品製造流程
用途:
• 供 TFDA 審查製造廠是否具備穩定生產該醫材之能力
• 包含製程、作業步驟、管制點
提供者:
• 由製造廠提供完整製程文件
6.醫療器材檔案清單
用途:
• 作為 TFDA 審查醫療器材技術文件完整性的依據
提供者:
• 製造廠提供相關設計、測試、風險、檢驗等技術資料清單
7.查廠報告
用途:
• 評估美國製造廠之品質系統是否符合規範
• 必須為自查廠日期起三年內之文件
提供者:
• 由 FDA 出具的 Establishment Inspection Report(EIR)
8.製售證明
用途:
• 證明該產品於美國可合法製造及銷售
• 必須為出具日起二年內之有效文件
提供者:
• 由 FDA 出具 Certificate to Foreign Government(CFG)
9.原製造許可
用途:
• 追加品項或展延案核對使用
提供者:
• 由申請者提供先前 TFDA 核准之文件
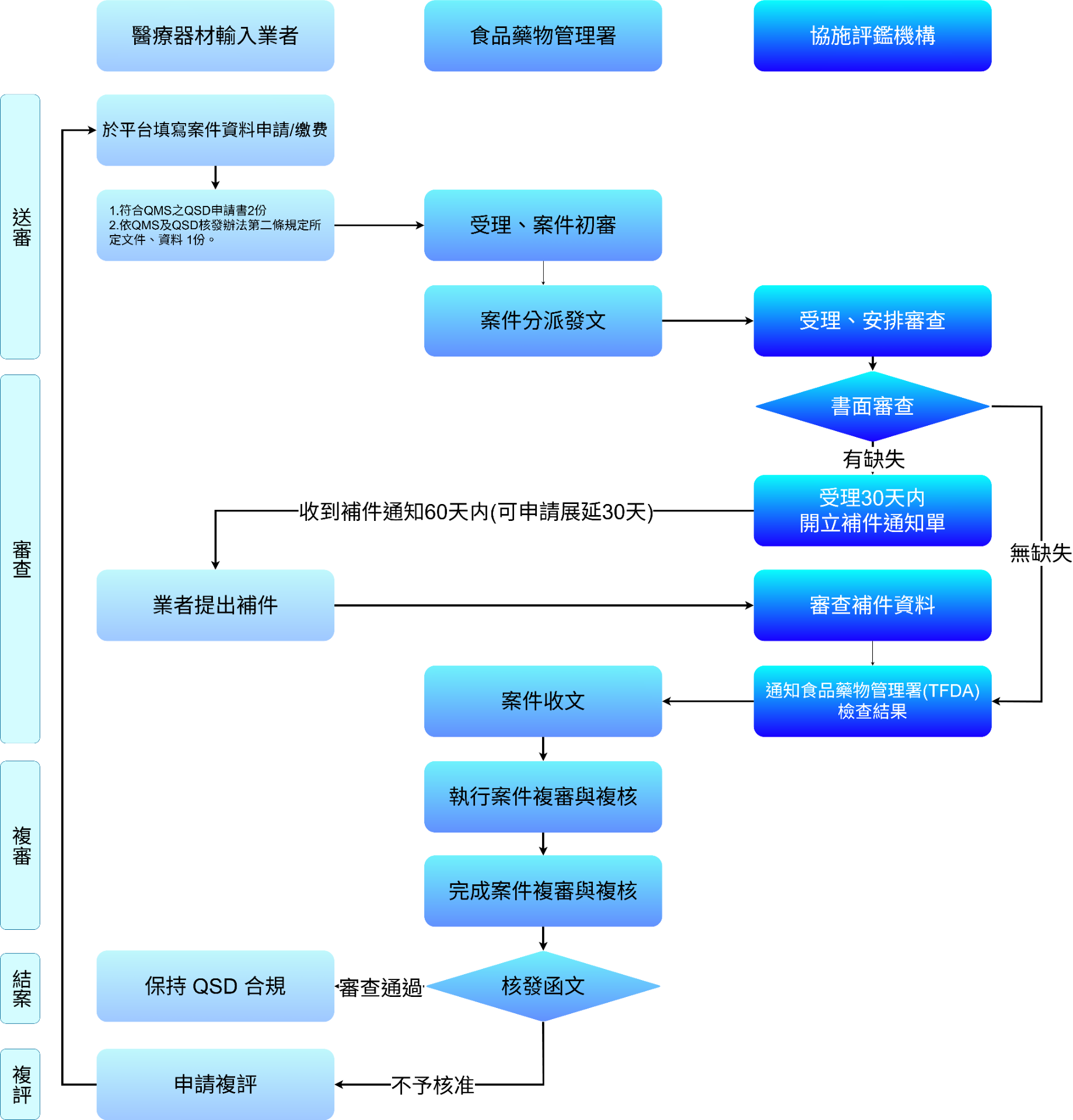
QSD作業流程圖

負責提出 QSD 申請、整合原廠文件、回覆補件及完成所有法規程序的主要窗口。

衛生福利部食品藥物管理署 (簡稱:TFDA, Taiwan Food and Drug Administration)台灣醫療器材與藥品的主管機關。

受 TFDA 委託,負責執行 QSD 的書面審查與查核工作的專業機構。